登记号:CTR20220704
LB1410 是由上海健信生物医药科技有限公司开发的重组人源化抗PD-1/TIM-3双特异性抗体(BsAb),是基于Keytruda的二代肿瘤免疫治疗产品,其能够阻断免疫检查点 PD-1 和 TIM-3介导的免疫抑制信号通路,并且在临床前研究中显示出比TIM-3和PD-1抗体联用更好的T/DC细胞活性和体内抗肿瘤效果。来源:医麦客
适应症:晚期恶性肿瘤
专业题目:评价注射用LB1410在晚期恶性肿瘤患者中的安全性、耐受性、药代动力学、药效学和免疫原性的多中心、开放的Ⅰ期临床研究

组长单位:本次临床试验国内研究者由 上海市肺科医院周彩存教授 牵头,该试验是国内多中心试验,全国有12家参研医院。
二、临床试验信息
1.年龄18-75岁,性别不限,要求生活自理,CT至少有一个可评估的肿瘤病灶
2.诊断:晚期恶性实体瘤或淋巴瘤患者
既往接受过抗 PD1/抗 PD-L1 抗体和铂类药物化疗失败的组织学确诊的晚期或转移性非小细胞肺癌患者
至少经过 2 线标准治疗失败的晚期非微卫星不稳定的结直肠癌患者,未经抗 PD1/抗 PD-L1抗体治疗;
经过抗 PD-1/PD-L1 抗体治疗失败的复发或转移的 MSI-H 或 dMMR 晚期实体瘤;
至少经过 2 线标准治疗失败的晚期其他实体瘤或淋巴瘤患者,其中至少一个既往治疗线包含抗 PD-1/PD-L1 抗体,且抗 PD-1/PD-L1 抗体继发耐药(优先入选食管鳞癌、黑色素瘤、肾癌、肝癌、头颈鳞癌、尿道上皮癌、子宫内膜癌、宫颈癌、肛门癌、经典霍奇金淋巴瘤。
3. 队列 A要求 PD-L1 和 TIM3 高表达, 队列 B要求≥2 线标准治疗失败,且其中抗 PD1/抗 PD-L1 抗体原发耐药患者要求 PD-L1 和 TIM3 高表达;
备注: TIM3 高表达:经中心实验室组织检测 TIM3 免疫细胞或肿瘤细胞阳性率 ≥ 20%;PDL1 高表达:既往报告或经中心实验室组织检测 PDL1 TPS ≥ 10% 或 CPS ≥ 10。
排除:乙肝、结核或者研究者评估后不适合入组的诸多因素
【治疗方案】
试验组:注射用LB1410,规格:100mg/瓶
用法用量:预设9个剂量组 (1)0.001 mg/kg;(2)0.01 mg/kg;(3)0.06 mg/kg;(4)0.3 mg/kg;(5)1 mg/kg;(6)3 mg/kg;(7)6 mg/kg;(8)10 mg/kg; (9) 15 mg/kg; 均为静脉给药,2周/次。
三、参研中心(知名三甲医院)
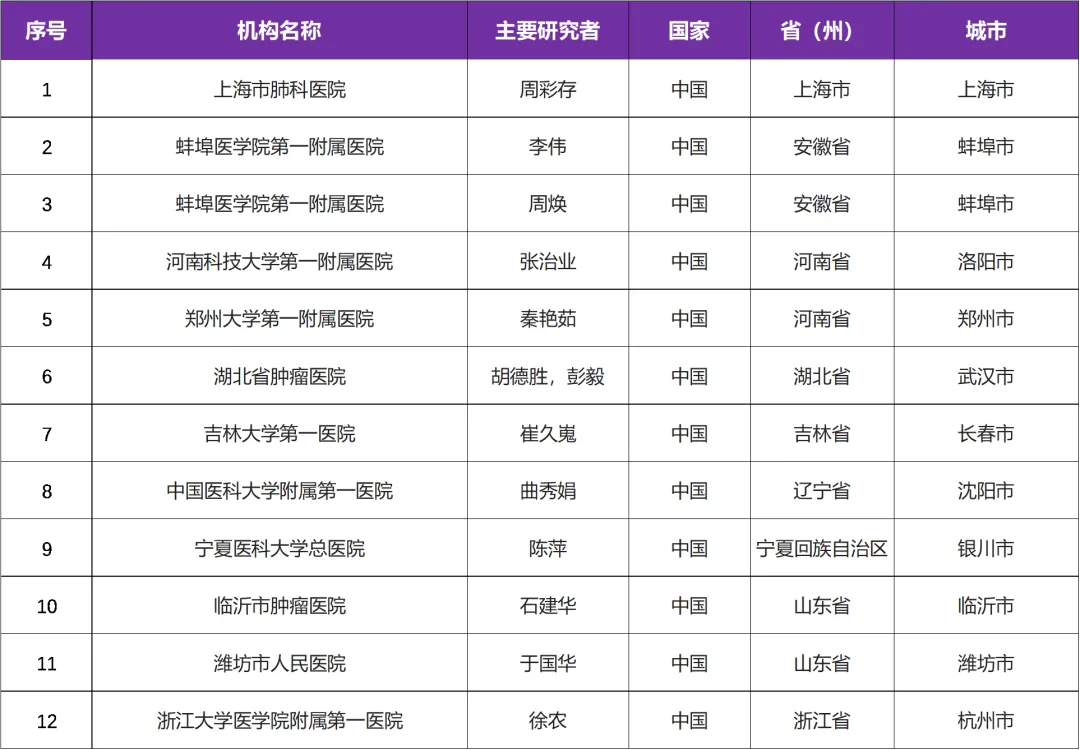 来源:以上信息来自国家药品监督管理局药品审评中心,网址为http://www.chinadrugtrials.org.cn 登记号:CTR20220704 即可查询 I 来源:百度百科 I 题图来源:视觉中国
来源:以上信息来自国家药品监督管理局药品审评中心,网址为http://www.chinadrugtrials.org.cn 登记号:CTR20220704 即可查询 I 来源:百度百科 I 题图来源:视觉中国
