药物名称:Belzutifan片(MK-6482)
Belzutifan是美国FDA批准的首个缺氧诱导因子(HIF-2α)抑制剂,已于2021年8月获得FDA批准上市,用于治疗von Hippel-Lindau(VHL)疾病相关癌症。值得一提的是,靶向HIF-2α信号通路的相关研究曾在2019年荣获诺贝尔生理学或医学奖。
Belzutifan是一种研究性、新型、强效、选择性口服HIF-2α抑制剂,目前正在多个临床研究中进行评估,治疗VHL相关性肾细胞癌、晚期肾细胞癌以及晚期实体瘤患者等。VHL是一种肿瘤抑制蛋白,该蛋白失活可异常激活癌症患者体内的HIF-2α蛋白,HIF-2α因子可在患者体内蓄积并导致良性和恶性肿瘤的形成。基于belzutifan在临床试验中取得的积极结果,FDA曾授予该产品突破性疗法认定和孤儿药资格。
此前,belzutifan已在治疗与VHL疾病相关肾细胞癌患者的2期临床试验中获得积极结果,并在《新英格兰医学杂志》上发表。结果显示,在61名接受治疗的肾细胞癌患者中,30名(49%)获得部分缓解,另有30名患者(49%)疾病稳定。92%的患者中观察到肿瘤病灶的缩小。在24个月时,患者的无进展生存率为95%。截至数据收集截止日,89%的患者仍然在接受治疗。
肾透明细胞癌是常见的一种肾细胞癌,约占所有肾细胞癌病例的70%。对于晚期肾透明细胞癌患者,一线治疗可以选择PD-1/PD-L1抑制剂联合CTLA-4抑制剂或血管内皮生长因子(VEGF)受体酪氨酸激酶抑制剂(TKI)。然而,大约20%至30%的肾细胞癌患者被诊断时肿瘤已经发生转移,部分患者接受治疗后最终还是会经历疾病进展,这些患者治疗前景不容乐观。来源:新浪医药
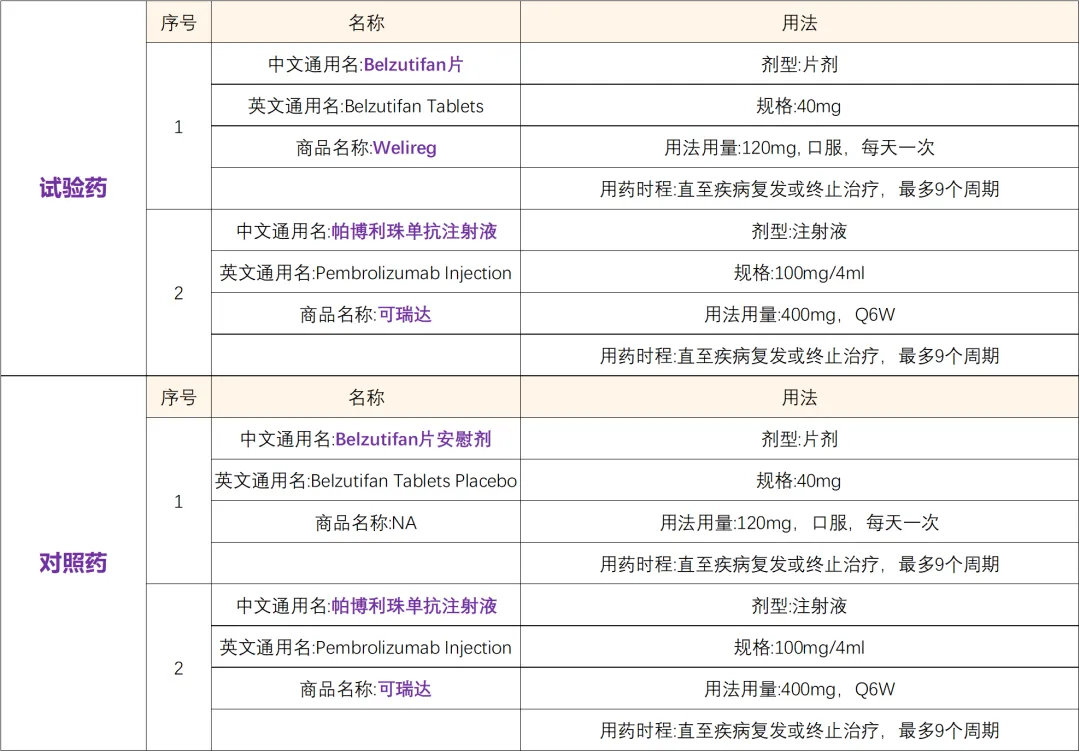
专业题目:一项在接受肾切除术后的肾透明细胞癌(ccRCC)受试者中评估Belzutifan(MK-6482)联合帕博利珠单抗(MK-3475)对比安慰剂联合帕博利珠单抗作为术后辅助治疗的有效性和安全性的多中心、双盲、随机III期研究(MK-6482-022)
 信息来源:百度百科
信息来源:百度百科
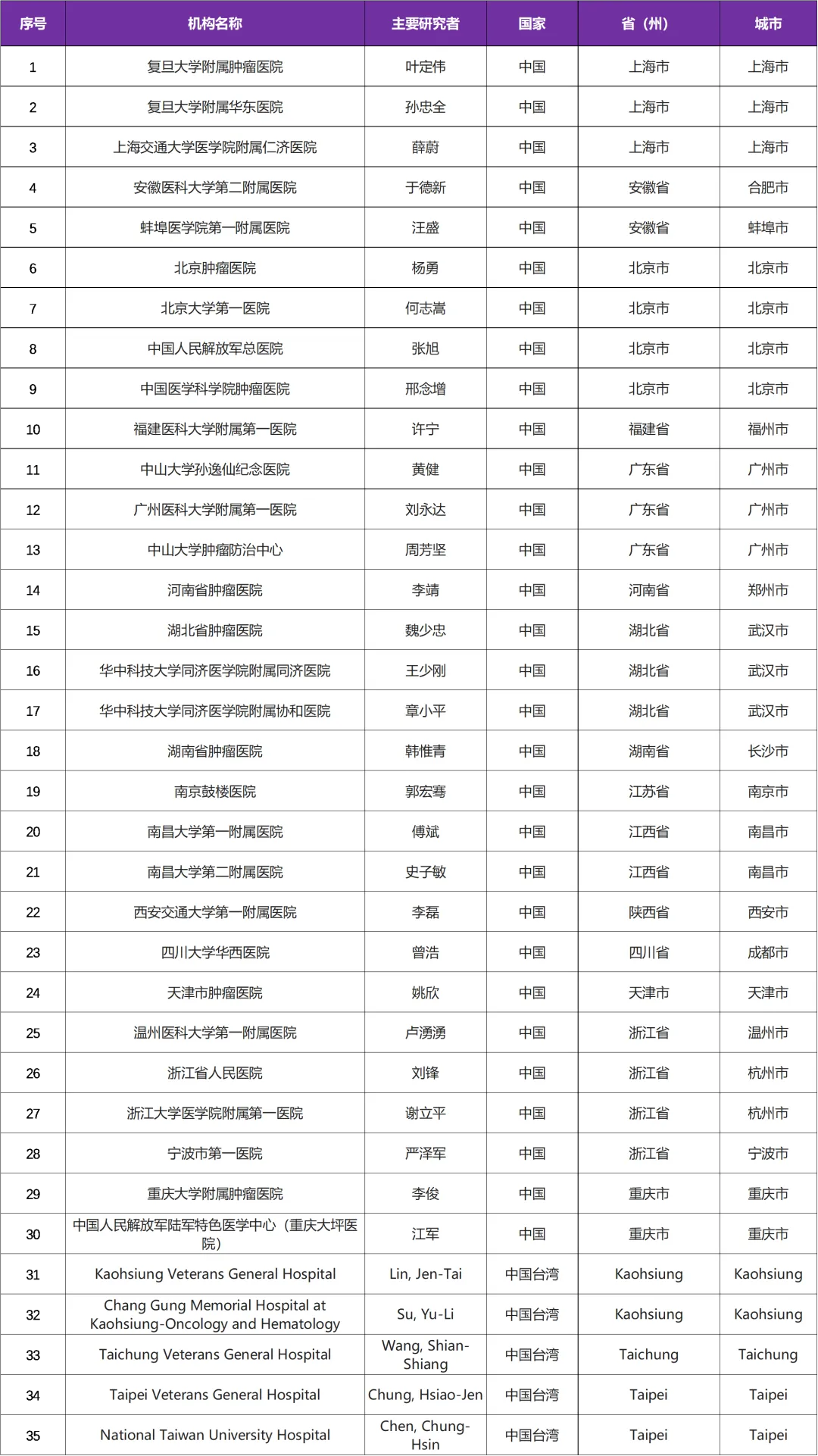
本次临床试验国内主要研究者由 复旦大学附属肿瘤医院叶定伟教授 牵头,该试验是国际多中心试验,全球224家医院,其中参研机构有国内 35 家医院
1.年龄≥18岁,男女不限,ECOG评分0~1分;2.诊断:经组织学或细胞学确诊的有透明细胞成分的肾癌,伴或不伴肉瘤样特征。患有中高危、高危或M1 NED RCC(已经完全切除原发性肿瘤(部分或根治性肾切除),和完全切除实体、孤立的软组织转移病灶的M1 NED受试者。)随机分组前≤12周内必须进行过肾切除术和/或转移灶切除术。1.肾切除术后肾静脉或腔静脉有残余血栓;有脑或骨转移病灶。2.在研究干预首次给药前6个月内患有临床严重心血管疾病。
三、参研中心(知名三甲医院)
以上信息来自国家药品监督管理局药品审评中心,网址为http://www.chinadrugtrials.org.cn
登记号:CTR20220945即可查询
