Ø慢性非特异性肠道炎症性疾病,主要累及直肠和结肠,多呈反复发作
Ø中国UC患病率为11.6/10万人
Ø最常发生于青壮年期,我国高发年龄为20岁~49岁,性别差异不明显
Ø持续或反复发作的腹泻、黏液脓血便,伴腹痛、里急后重和不同程度的全身症状,病程多在4~6周以上
Ø治愈难度大、复发率高、且有癌变的可能
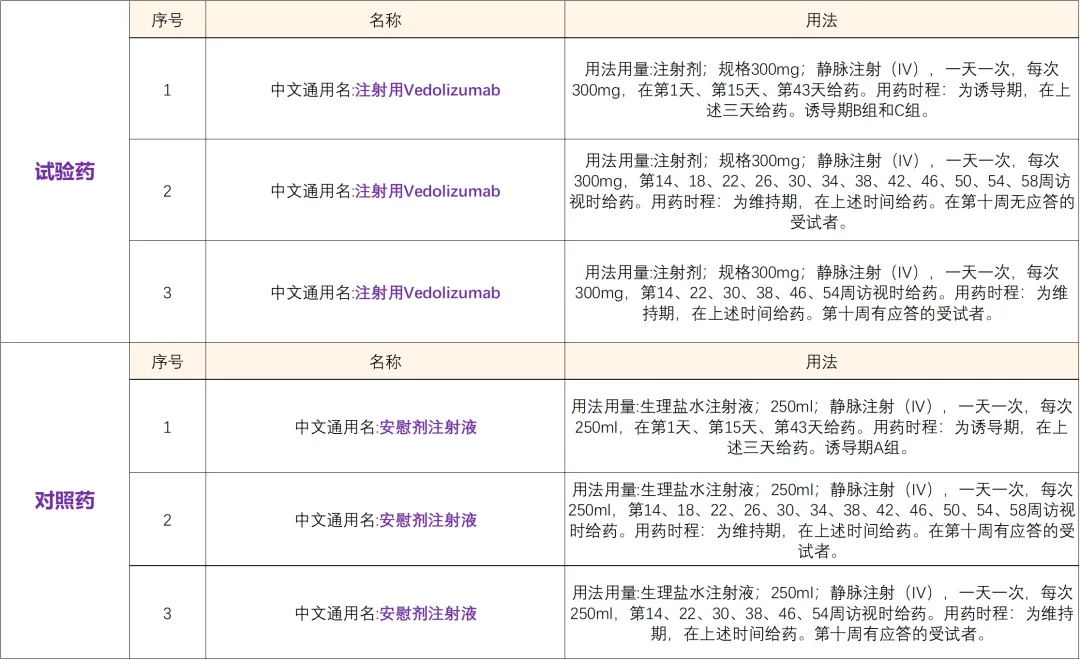
药物名称:注射用Vedolizumab (日本武田原研药物)Vedolizumab 是人化免疫球蛋白(Ig)G1单克隆抗(mAb),靶向人淋巴细胞整合素α4β7,通过与α4β7整合素结合,拮抗其与MAdCAM-1的粘附作用,因此损害肠道白细胞归巢迁移进胃肠道黏膜的能力,是肠道选择性的免疫调节剂,已被开发用以治疗UC和CD
Vedolizumab 自2014年5月份已经在多个地区(包括美国和欧盟)获得上市许可,用于治疗常规治疗失败的中重度活动性溃疡性结肠炎或者CD成年患者。
自Vedolizumab IV获得上市许可以来,其患者累积暴露量据估计约为77, 382患者/年, 在既往临床研究中已显示出可接受并且稳定的安全性特征,包括持久的临床应答、持久的临床缓解和黏膜愈合。
适应症:溃疡性结肠炎(对传统治疗或进阶治疗应答不足)专业题目:在中重度活动性溃疡性结肠炎受试者中评价Vedolizumab(IV)有效性和安全性的III期、随机、双盲、安慰剂对照、平行组研究 信息来源:百度百科
信息来源:百度百科
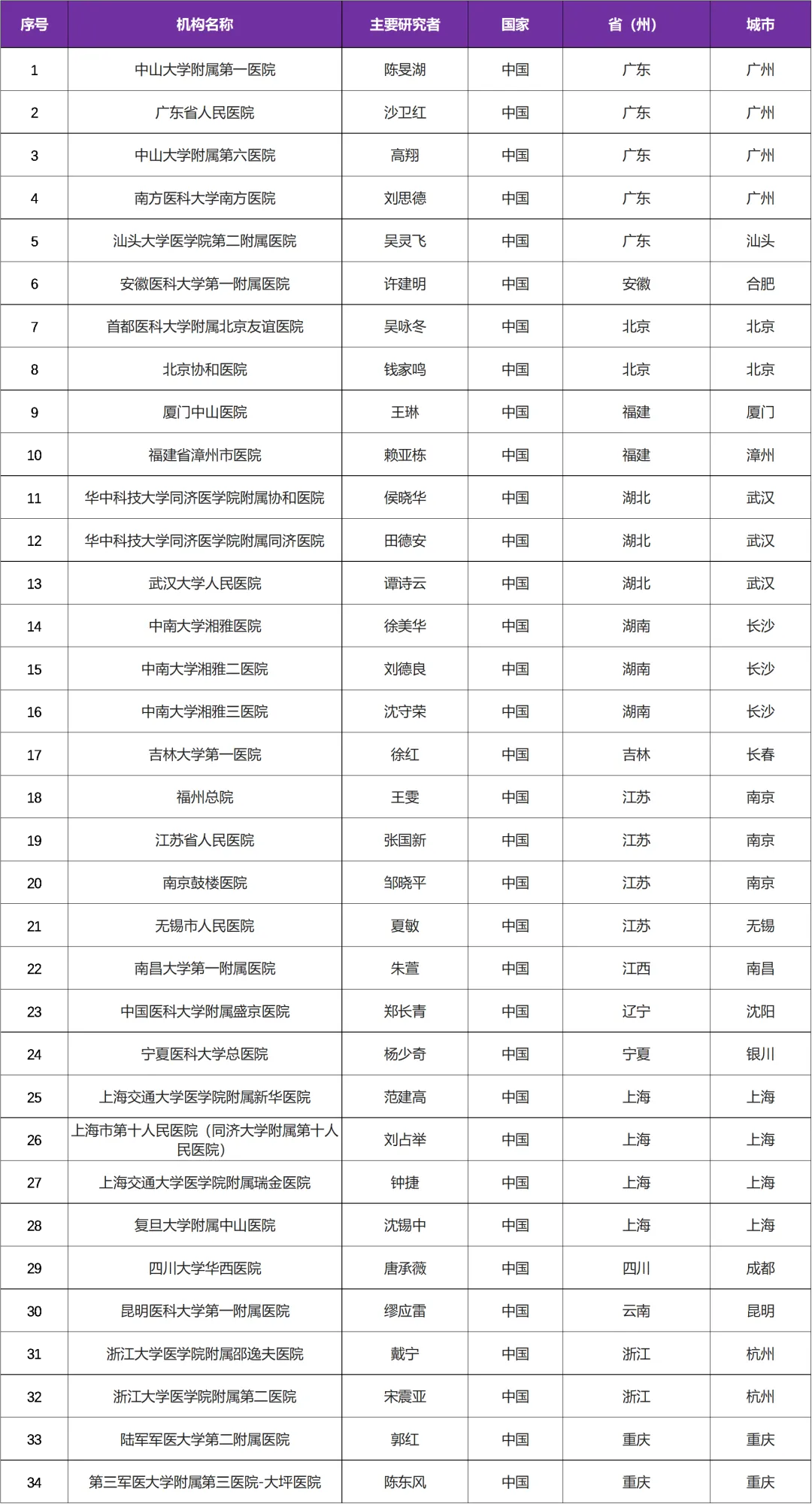
本次临床试验主研中心/研究者: 中山大学附属第一医院陈旻湖教授 牵头
国内共有34家医院参研中心
1.年龄为18至80岁(含);
2.经内镜及病理确诊为溃疡性结肠炎至少3个月;
3.中重度的活动性UC,定义为MAYO评分6-12分,其内镜分项评分≥2分;
4.肠镜显示受累结肠≥15 cm, 排除溃疡性直肠炎;
5.受试者接受过下列至少一种药物治疗,并且已证明疗效不佳、无效或不耐受:
Ø皮质类固醇:泼尼松、布地奈德,甲强龙等
a)剂量≥40 mg/日持续治疗≥1周(口服或静脉注射)或剂量30-40 mg/日持续治疗≥2周(口服或静脉注射)之后,疗效不佳)
b)在逐渐减量<10 mg/日或者治疗中止后3个月内复发
Ø免疫调节剂:硫唑嘌呤、6-巯基嘌呤等,但排除环孢菌素(随机化30天前使用)
a)既往至少接受过1次硫唑嘌呤≥0.75 mg/kg/日、6-巯基嘌呤(6-MP)≥0.5 mg/kg/日、或甲氨蝶呤(MTX)注射剂≥15 mg/周的为期12周的治疗方案,依然具有持续活动性疾病的体征和症状
ØTNF-α拮抗剂:如英夫利昔单抗(类克)、戈利木单抗和阿达木单抗(修美乐)等
a)药品说明书规定剂量接受诱导治疗之后,疗效不佳
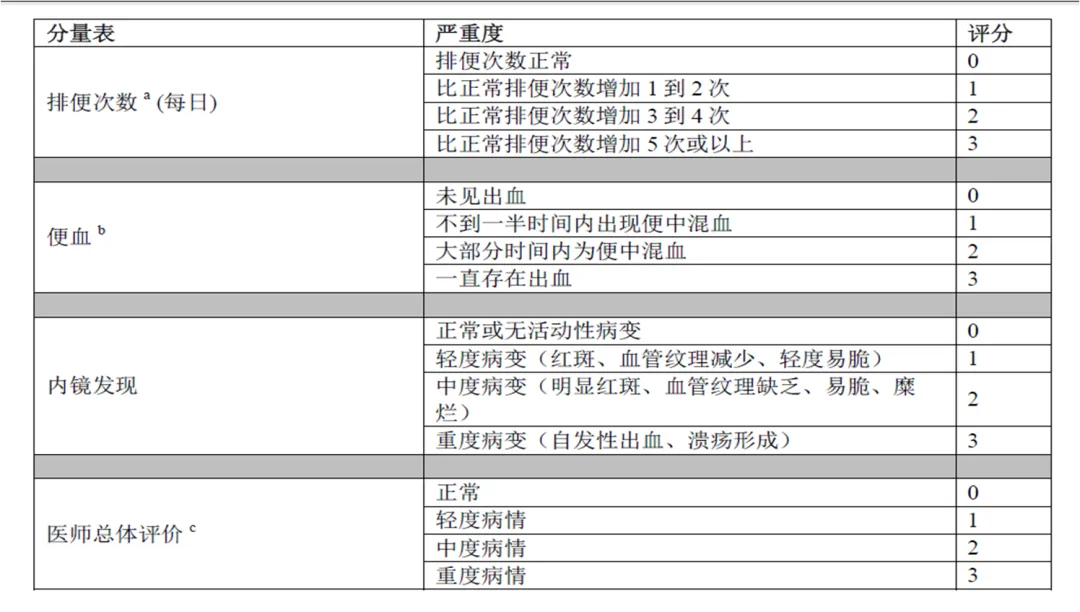
总Mayo评分至少为6分,但不超过12分,其中结肠镜检查分项的评分≥2分
1.首次筛选访视时,受试者出现腹腔脓肿或者中毒性巨结肠证据。
2.受试者曾接受过广泛结肠切除术,次全或者全结肠切除术。
3.受试者目前正行回肠造口术、结肠造口术或者出现小肠狭窄已知的固定症状。可接受回肠造口术或结肠造口术病史已逆转的受试者。
4.随机化前30天内,受试者接受下列任一种药物治疗基础疾病:
- 非生物(如环孢菌素、沙利度胺)治疗或者传统中药(第7.3.1节专门列出的允许治疗UC的药物除外)。
- 研究方案中列出的已获批或正在进行试验的非生物疗法或者传统中药。
5、筛选前60天或者5个药物半衰期内(两者取其长),使用任何试验药物或已获批的生物制剂及生物类似药。
6、受试者既往暴露于已获批或试验用抗整合素抗体(如,那他珠单抗、依法利珠单抗、etrolizumab或AMG-181)或黏膜地址素细胞黏附分子-1(MAdCAM)拮抗剂或利妥昔单抗。
7、受试者具有尚未切除的腺瘤性结肠息肉病史或证据,或具有结肠黏膜发育不良病史或证据,包括低级别或高级别发育不良,以及未定型发育不良。
三、国内参研医院
以上信息来自国家药品监督管理局药品审评中心,网址为http://www.chinadrugtrials.org.cn
登记号:CTR20170804即可查询

扫描添加受试者助手直接沟通