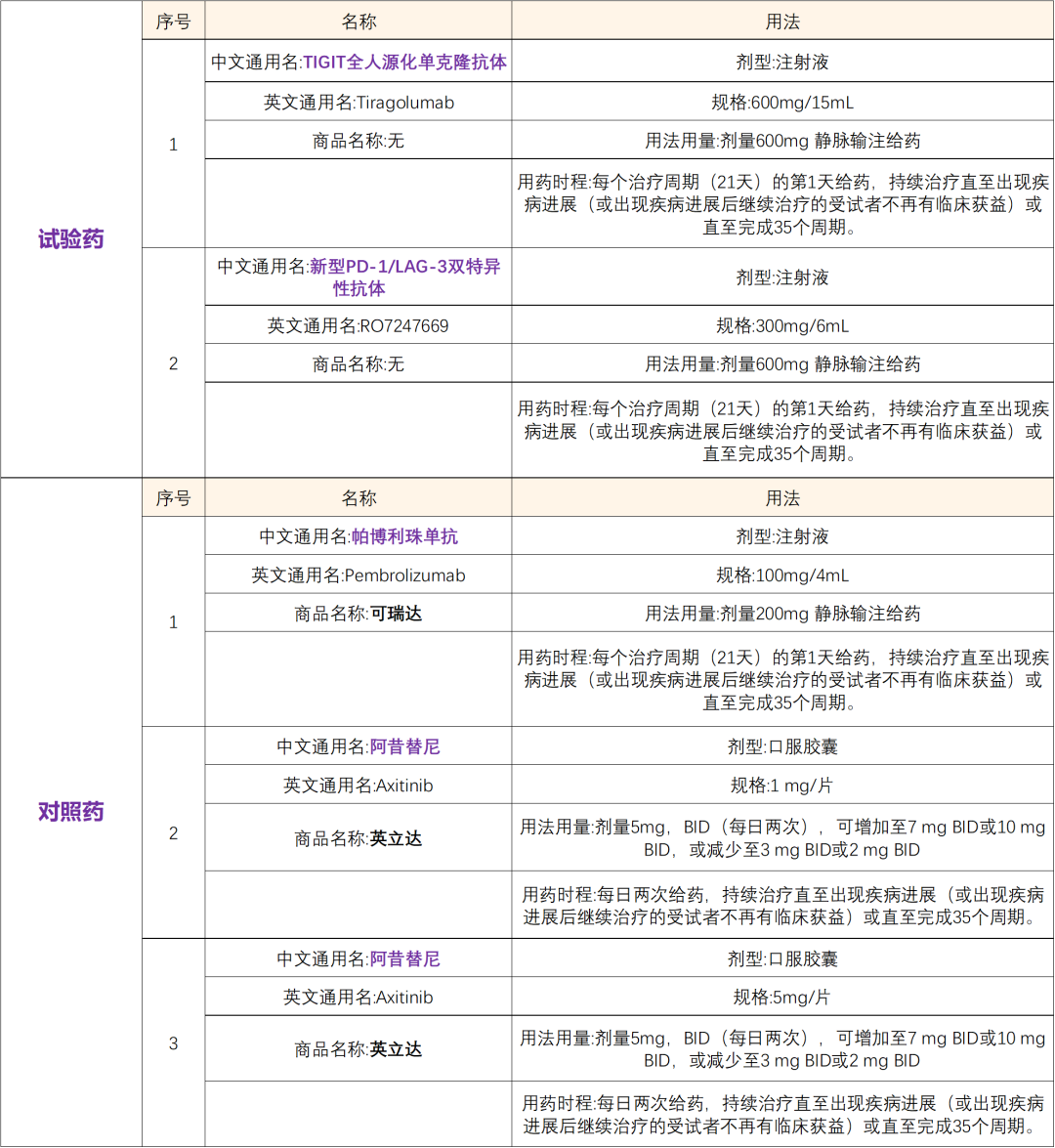
药物名称:Tiragolumab (替瑞利尤单抗)
Tiragolumab获得美国FDA突破性疗法认定(BTD),拟用于联合阿替利珠单抗(atezolizumab)一线治疗肿瘤PD-L1高表达且无EGFR或ALK基因组肿瘤畸变的转移性非小细胞肺癌(NSCLC)患者。Tiragolumab是首个获得FDA授予BTD的抗TIGIT分子,本次认定基于名为CITYSCAPE的2期临床试验数据。CITYSCAPE试验表明,同时靶向免疫抑制受体TIGIT和PD-L1,可能通过潜在放大免疫反应来增强抗肿瘤活性。
2020年8月25日,TIGIT单抗Tiragolumab(替瑞利尤单抗)注射液在中国获批临床,联合阿替利珠单抗联合治疗不可切除的局部晚期复发性或转移性食管鳞癌。
RO7247669为罗氏开发的靶向PD-1和LAG-3的双特异抗体,其与PD-1有较高的亲合力,而与LAG-3的亲合力较低,同时通过PGLALA突变去除抗体的Fc相关效应来源:药融圈
适应症:肾细胞癌
通俗题目:使用免疫检查点抑制剂联合阿昔替尼治疗既往未经治疗的不可切除局部晚期或转移性肾细胞癌患者的II期研究
 信息来源:百度百科
信息来源:百度百科
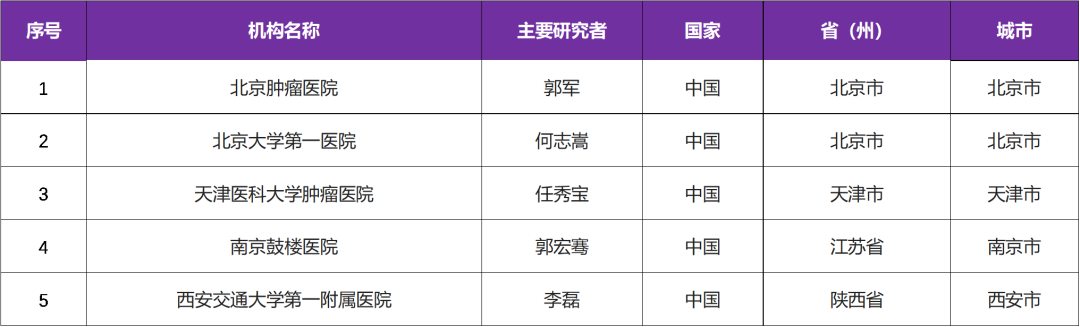
本次临床试验国内主要研究者由 北京肿瘤医院郭军教授 牵头,该试验是国际多中心试验,参研机构有国内 5 家医院
1.年龄≥18岁,男女不限,ECOG评分0~1分;2.诊断:国际转移性RCC数据库联盟中危或高危,经组织学证实的ccRCC(肾透明细胞癌);不可入组nccRCC亚型(乳头状、嫌色细胞、未分类)1.先前接受过针对局部和/或转移性肾细胞癌的全身性治疗2.不可控或症状性高钙血症;脑转移;乙肝、丙肝及结核等疾病
三、参研中心(知名三甲医院)
来源:以上信息来自国家药品监督管理局药品审评中心,网址为http://www.chinadrugtrials.org.cn 登记号:CTR20230315即可查询 题图来源:视觉中国
